
Au 4ème siècle avant notre ère, le philosophe Démocrite
pense que la matière est formée de grains invisible : les
atomes (du grec atomos : qu'on ne peut diviser).
Démocrite pense que les atomes sont pleins mais tous différents
: certains crochus, ronds etc… pour les emboîter ensemble (avoir
des atomes crochus avec quelqu'un : bien s'entendre avec cette personne)
Mais Démocrite n'a aucune preuve expérimentale et sa démarche
n'est que philosophique.


Le philosophe grec Aristote rejette cette théorie et reprend l'idée des 4 éléments, c'est sur cette fausse idée que vont reposer les travaux des alchimistes pendant plus de 20 siècles.

Au Moyen Âge


La chimie moderne est amorcée par le Français Jean Rey qui reconnaît, dès 1630, la conservation de la masse dans les transformations chimiques et le rôle de l'air dans les combustions.
L'Irlandais Robert Boyle, dès 1661, fait la distinction entre mélanges et combinaisons chimiques.
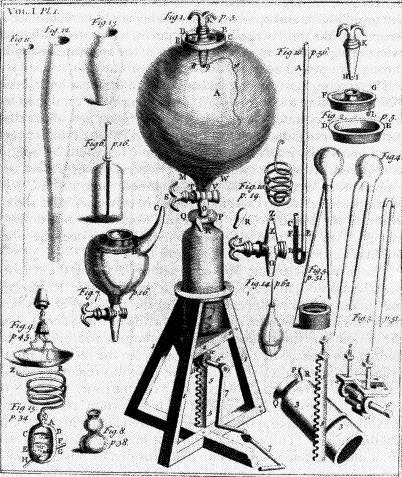
Pompe à air de Robert Boyle
Au XVIIIe siècle, la chimie devient une véritable science avec le Britannique Joseph Priestley et le Français Antoine Laurent de Lavoisier qui imposent, par des méthodes dignes de la recherche actuelle, de nouvelles règles de nomenclature permettant de comprendre le processus des combinaisons chimiques.
Lavoisier définit l'élément chimique, qui ne peut pas être décomposé en substances plus simples par la chaleur ou par une réaction chimique, ainsi que le composé, qui est la combinaison de deux éléments, ou plus, dans une proportion de poids déterminée.


